 Un microbiote est l’ensemble des micro-organismes (bactéries, virus, parasites et champignons) non-pathogènes.
Un microbiote est l’ensemble des micro-organismes (bactéries, virus, parasites et champignons) non-pathogènes.
Dans l’organisme, il existe différents microbiotes : au niveau de la peau, de la bouche, du vagin, des poumons… Le microbiote intestinal (appelé aussi flore intestinale) est le plus « peuplé » d’entre eux. Il joue un rôle primordial pour notre bien-être et notre santé, et son équilibre (eubiose) est gage de bonne santé.
On sait désormais qu’il joue un rôle important dans nos fonctions digestives, métaboliques, immunitaires et neurologiques.
C’est lorsque notre microbiote intestinal dysfonctionne que nous parlons alors de dysbiose. Cette altération de l’équilibre de la microflore normale peut avoir plusieurs origines et de nombreuses conséquences, dont le développement de maladies inflammatoires chroniques de l’intestin (MICI), ou la genèse des maladies cardio, cérébro-vasculaires (athérosclérose, hypertension, AVC…), cardio-métaboliques (diabète, obésité), voire de cancers (colorectal, gastrique ou œsophagien). [1][2][3]
D’où vient notre microbiote ? [1]
À la naissance, le microbiote d’un individu se constitue progressivement, d’abord au contact de la flore vaginale et fécale de la mère lors de l’accouchement par voie basse, ou à celui des micro-organismes de l’environnement en cas de naissance par césarienne. Le microbiote de la mère joue donc un rôle déterminant. La colonisation bactérienne a ensuite lieu graduellement chez l’enfant et son développement en bonne santé dépend en particulier de la qualité de son microbiote.
Pendant les premières années de vie, la composition du microbiote intestinal va évoluer qualitativement et quantitativement, sous l’influence de la diversification alimentaire, de la génétique, du niveau d’hygiène, des traitements médicaux reçus et de l’environnement. Cette composition reste ensuite assez stable.
Le microbiote intestinal assure son bon fonctionnement et son renouvellement en puisant dans nos aliments (notamment dans les fibres alimentaires). Dans le même temps, les micro-organismes qui le constituent jouent un rôle direct dans la digestion (fermentation des résidus alimentaires, assimilation des nutriments, synthèse de certaines vitamines…) et participent au fonctionnement du système immunitaire intestinal, et ainsi limitent les mécanismes d’inflammation.
Pourquoi notre microbiote dysfonctionne-t-il ? [2]
Les origines de la dysbiose sont multiples...
Lorsque notre alimentation est trop riche en graisses et trop pauvre en fibres
Le régime alimentaire « occidental » (riche en graisses et en protéines et pauvre en fibres) peut perturber la microflore intestinale. Les aliments responsables sont la viande, les graisses, certaines huiles, la confiserie, et la restauration rapide (excessive en glucides raffinés et acides gras oméga-6 polyinsaturés).
Ce régime alimentaire propre au monde occidental favorise l’expansion d’agents pathogènes dans le tube digestif, ce qui conduit à une diminution de la représentation de nos « bonnes bactéries ». Les « mauvaises bactéries » quant à elles, de par leur métabolisme, nous exposent à des constituants néfastes qu’ils produisent (comme le sulfure d’hydrogène) et réduisent les bénéfices des bonnes bactéries (acides gras à chaînes courtes, minéraux, etc …).
Ils induisent également une réponse immunitaire, provoquant la production de cytokines pro-inflammatoires augmentant ainsi l’inflammation intestinale.
Les fibres, les fruits et les légumes ont quant à eux, un rôle de protection. Ils augmentent l’expression et l’activité des enzymes participant à la détoxification de l’intestin. De plus, les fibres sont d’excellents prébiotiques, nécessaires à la croissance et la prolifération des bonnes bactéries de notre système digestif.
Lorsqu’une rupture brutale de notre équilibre intestinal à lieu
En causes de rupture brutale de l’équilibre de notre flore intestinale, on peut citer l’infection gastro-intestinale aiguë et la prise d’antibiotiques (même pour le traitement d’une infection extra-intestinale).
- Il a été montré qu’entre 5 et 30 % des patients ayant eu un épisode aigu de gastro-entérite infectieuse développent des symptômes gastro-intestinaux chroniques (même après élimination de l’agent pathogène à l’origine de l’infection).
- Il a été montré à plusieurs reprises que l’exposition aux antibiotiques durant la petite enfance (quand l’eubiose n’est peut-être pas encore totalement établie) interférait avec le processus normal de développement des bactéries intestinales. L’utilisation des antibiotiques se traduirait donc par une diminution du nombre de bactéries bénéfiques (comme les bactéries du genre Bifidobacterium et Lactobacillus) et par une augmentation du nombre de bactéries pathogènes, comme l’Escherichia coli, ayant la capacité d’adhérer et d’envahir la muqueuse intestinale.
Un excès d’hygiène dans la petite enfance [4]
Quand on parle d’hygiène excessive, on parle d’exposition insuffisante à une diversité de micro-organismes et d’agents infectieux durant l’enfance. On parle alors de manque d’éducation du système immunitaire.
L’amélioration de l’hygiène (disponibilité de l’eau potable filtrée, hygiène domestique et conditions sanitaires alimentaires) est évidement en cause. Vivre en milieu urbain et avoir un statut socioéconomique élevé seraient donc un facteur de risque. L’enfant deviendra donc intolérant à certains micro-organismes faute d’y avoir été exposé.
L’allaitement maternel, peut offrir une meilleure exposition aux micro-organismes, avec une plus grande diversité (en fonction de ce que la mère consomme ou est exposée), que les préparations pour nourrisson, et ainsi avoir un effet bénéfique sur la maturité intestinale de l’enfant, et donc sur sa santé intestinale et générale.
Quelles sont les conséquences de la dysbiose ?
La dysbiose peut s’exprimer à travers divers symptômes : [5]
- En local : la dysbiose se traduit par des ballonnements, flatulences, spasmes, assimilation insuffisante des nutriments, inflammation avec perte de perméabilité intestinale, … pouvant entraîner des réactions immunitaires importantes (production de complexes antigène-anticorps en réponse à cette inflammation)
- En périphérie : on observe une sur-sollicitation ou congestion des organes annexes dont le fonctionnement pourra être altéré : foie, vésicule biliaire, pancréas exocrine...
- Au niveau systémique : on constate une aggravation de troubles liée à l'inflammation (migraines, arthrose, arthrite, maladies auto-immunes, etc) ainsi que des modifications du système nerveux central (irritabilité, changements d'humeur, anxiété, etc.)
S’en suivent alors la survenue de maladies inflammatoires chroniques de l’intestin (MICI), mais pas seulement.
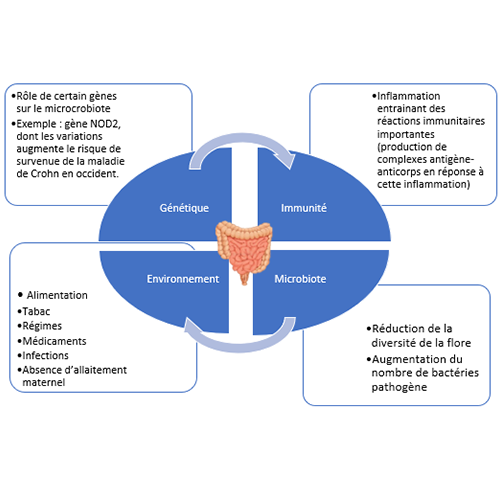
Les MICI : le cercle vicieux de la dysbiose [1][2]
La maladie de Crohn (MC) et la rectocolite hémorragique (RCH) sont deux maladies inflammatoires chroniques de l’intestin (MICI). Elles se caractérisent par une inflammation de la paroi du tube digestif liée à une hyperactivation du système immunitaire digestif. On dit souvent que la dysbiose est à la fois une cause et une conséquence de la maladie : elle apparaîtrait sous l’influence de facteurs génétiques et environnementaux, est source d’inflammation et l’entretient…engendrant ainsi un cercle vicieux.
Figure adaptée Microbiote intestinal et développement des maladies inflammatoires chroniques de l’intestin, Oumaira Rahmouni, Laurent Dubuquoy, Pierre Desreumaux, Christel Neut médecine/sciences 2016 ; 32 : 968-73
Les maladies métaboliques et cardiovasculaires : l’intestin en cause ? [1]
L’athérosclérose, l’hypertension, l’AVC, le diabète, l’obésité… ont une origine multifactorielle, à la fois génétique, nutritionnelle et environnementale. La part respective de chacun de ces facteurs est variable d’un individu à l’autre mais il apparaît de plus en plus clairement que le microbiote intestinal joue un rôle dans l’apparition de ces maladies. Par exemple, dans le diabète ou l’obésité, il existe une inflammation chronique, favorisée par l’augmentation des « mauvaises graisses » (comme décrit précédemment) dans l’alimentation. Ces graisses vont augmenter la proportion des bactéries pathogènes dans l’intestin favorisant l’installation d’une inflammation chronique qui va à son tour favoriser l’apparition d’une insulinorésistance, préalable au diabète et à l’obésité.
Quand le déséquilibre mène au cancer [1] [6]
Comme dit précédemment, la dysbiose joue d’abord un rôle dans la survenue d’états précancéreux comme l’obésité et le syndrome métabolique. Progressivement, l’efficacité du système immunitaire est altérée, l’inflammation s’installe et peut favoriser l’apparition ou la progression d’un cancer.
Evidemment, comme on peut s’en douter, la dysbiose joue également un rôle direct dans le cancer colorectal, en entrainant la prolifération de microbes dans les tissus colorectaux et la muqueuse adjacente. Cependant, il n’a pas encore été montré clairement quels types de bactéries étaient à l’origine de cette dérive en cancer.
La dysbiose en cause dans les troubles neurologiques [1]
L’intestin est en interaction étroite avec le système nerveux central (SNC). On parle d’un axe intestin-cerveau, à travers lequel les deux organes communiquent.
Des données récentes, suggèrent qu’une dysbiose pourrait être un élément précoce dans le développement de certaines pathologies neurodégénératives telles que la maladie de Parkinson.
Dans la maladie d’Alzheimer, les données sont moins probantes, mais une modification du microbiote a été mise en évidence dans les phases précoces du déclin cognitif.
D’autres pathologies neuropsychiatriques, comme la schizophrénie, l’anxiété, la dépression ou les troubles bipolaires pourraient aussi être concernées par des modifications de la composition du microbiote.
Les solutions naturelles pour rééquilibrer la dysbiose
Réformer son alimentation [7] [8]
 Nous avons vu que l’alimentation est une cause de la dysbiose. Elle en est aussi la solution ! Elle permet de prévenir celle-ci et la prendre en charge, en adoptant une consommation élevée en fibre et produits fermentés
Nous avons vu que l’alimentation est une cause de la dysbiose. Elle en est aussi la solution ! Elle permet de prévenir celle-ci et la prendre en charge, en adoptant une consommation élevée en fibre et produits fermentés
On appelle fibres alimentaires les aliments issus des parties structurantes des végétaux et qui ne peuvent pas être complètement dégradées par les enzymes digestives humaines : fruits, légumes, graines, noix etc.
Les produits fermentés quant à eux sont des aliments fermentés par l’action de micro-organismes (levures, champignons, bactéries, moisissures) transformant l’eau et le sucre de l’aliment en acide : yaourt, fromage, kéfir, kombucha, kimchi, légumes lactofermentés, etc.
Une étude très récente (2021) publiée dans Cell, a cherché à savoir si la supplémentation en fibres alimentaires ou en aliments fermentés pouvaient modifier la composition microbienne et influencer le système immunitaire. Deux groupes d’adultes en bonne santé ont été constitués : pendant 14 semaines, le 1er groupe a suivi un régime enrichi en fibres, le 2nd groupe un régime enrichi en produits fermentés.
- Le 1er groupe n’a pas vu de modification de sa diversité microbienne mais une amélioration de certaines fonctions microbiennes.
- Le 2nd groupe supplémenté en produits fermentés, a vu sa diversité microbienne augmenter de façon significative (indépendant des microbes présents dans les produits fermentés), ainsi que baisse des marqueurs de l’inflammation, comme la cytokine IL-6, impliquée dans diverses pathologies chroniques.
Les fibres améliorent donc les fonctions microbiennes de notre flore. Les produits fermentés permettent de la diversifier.
Quand l’alimentation ne suffit pas, la supplémentation est requise
Souvent, quand la dysbiose est bien installée, le seul changement de régime alimentaire ne suffit pas, et il est alors conseillé de se supplémenter.
Les probiotiques et les prébiotiques
Pour restituer l’équilibre de la flore intestinale, il est également possible de recourir aux compléments alimentaires, sous forme de cures de probiotiques/prébiotiques. Pour ce faire, il faut privilégier les associations de prébiotiques et de probiotiques.
La Glutamine [9]
La glutamine est un acide aminé bénéfique pour notre intestin, sous plusieurs angles :
- Elle est le carburant essentiel des cellules du tube digestif (entérocytes) et les cellules immunitaires (globules blancs)
- Elle protège notre intestin : l’effet barrière de la muqueuse intestinale dépend notamment de protéines qui assurent une cohésion entre les cellules intestinales (jonctions serrées). Il a été montré que la glutamine joue un rôle majeur dans le maintien de l’intégrité de ces jonctions serrées.
- Elle permet également d’éliminer les déchets azotés de l’organisme, ce qui est bénéfique pour le foie, le système nerveux et l’intestin.
- Elle est très utilisée chez les personnes présentant une hyperperméabilité intestinale.
On retrouve la glutamine dans la viande, le poisson, les produits laitiers, les céréales et les légumineuses.
L’Argile verte
Le recours à l’argile verte est une étape intéressante pour stopper le processus de dysbiose. En effet, elle va contribuer à l’élimination des déchets et ainsi diminuer l’encrassement, ce qui aura pour conséquences de réduire l’inflammation et l’acidité, protéger la muqueuse et restaurer l’intestin.
La transplantation fécale [10]
Le nom peut paraître barbare, mais il s’agit d’un très ancien traitement dont les origines remontent à la Chine du IVème siècle et dont le potentiel n’a été rigoureusement étudié en Occident qu’au début du 21ème siècle.
Quand les solutions naturelles précédemment évoquées ne fonctionnent pas, on peut avoir recours à la transplantation fécale. Ce traitement consiste à administrer au receveur malade les selles d’un donneur en bonne santé. Les selles du donneur sont diluées et filtrées avant d’être administrées au receveur. Plusieurs méthodes d’administration sont possibles : par coloscopie, par sonde nasogastrique ou encore sous forme de gélules.
Mis à jour le 19/08/2022
Bibliographie
[1]https://www.inserm.fr/dossier/microbiote-intestinal-flore-intestinale/
[2]https://www.medecinesciences.org/en/articles/medsci/full_html/2016/11/medsci20163211p968/medsci20163211p968.html
[3] Precision nutrition to target lipid metabolism alterations in cancer, Marta Gómez de Cedrón, Ana Ramírez de Molina, in Precision Medicine for Investigators, Practitioners and Providers, 2020 : https://www.sciencedirect.com/science/article/pii/B9780128191781000289
[4] Molodecky NA, Kaplan GG. Environmental risk factors for inflammatory bowel disease. Gastroenterol Hepatol 2010 ; 6 : 339-46.
[5] Kamyar M. Hedayat, Jean-Claude Lapraz and Ben Schuff, The Theory of Endobiogeny, Volume 4 Bedside Handbook 2020
[6]https://www.karger.com/Article/FullText/508328
[7] « Gut-microbiota targeted diets modulate human immune status » Wastyk et al. Cell 184, 4137–4153, August 5, 2021, https://doi.org/10.1016/j.cell.2021.06.019
[8] https://microbiome-foundation.org/est-il-possible-dameliorer-son-microbiome-par-la-consommation-de-fibres-ou-de-produits-fermentes/
[9] https://dumas.ccsd.cnrs.fr/dumas-03209260/document
[10] https://microbiome-foundation.org/