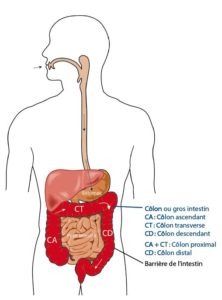
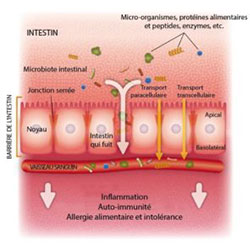
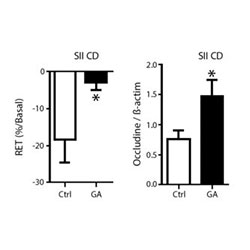
Sources :
1. J Acad Nutr Diet. 2012 May;112(5):642-8. doi: 10.1016/j.jand.2012.01.019. Epub 2012 Apr 25. Trends in dietary fiber intake in the United States, 1999-2008. King DE1, Mainous AG 3rd, Lambourne CA
2. Cherbut C, Michel C, Raison V, Kravtchenko T & Severine M (2003) Accacia gum is a bifidogenic dietary fiber with high digestive tolerance in healthy humans. Microbial Ecol Health Dis 15, 43–50.
3. Terpend K, Possemiers S, Daguet D and Marzorati M (2013) Arabinogalactan and fructo-oligosaccharides have a different fermentation profile in the Simulator of the Human Intestinal Microbial Ecosystem (SHIME®). Environ Microbiol Rep Aug;5(4):595-603.
4. Krack A, Sharma R, Figulla HR, Anker SD., The importance of the gastrointestinal system in the pathogenesis of heart failure., Eur Heart J. 2005 Nov;26(22):2368-74.
5. Zhen Zhang Y. and Li Y.Y., Inflammatory bowel disease: Pathogenesis. World J Gastroenterol. 2014 January 7; 20(1):91-99.
6. Nahidi L, Day AS, Lemberg DA, Leach ST., Differential effects of nutritional and non-nutritional therapies on intestinal barrier function in an in vitro model., J Gastroenterol. 2012 Feb; 47(2):107-17.
7. Leclercq S, Cani PD, Neyrinck AM, Stärkel P, Jamar F, Mikolajczak M, Delzenne NM, de Timary P., Role of intestinal permeability and inflammation in the biological and behavioural control of alcohol-dependent subjects., Brain Behav Immun. 2012 Aug; 26(6):911-8.
8. Vaarala O, Atkinson MA, Neu J., The “perfect storm” for type 1 diabetes: The complex interplay between intestinal microbiota, gut permeability, and mucosal immunity. Diabetes. 2008 Oct; 57(10):2555-62.
9. Maes M, Kubera M, Leunis JC., The gut-brain barrier in major depression: Intestinal mucosal dysfunction with an increased translocation of LPS from gram negative enterobacteria (leaky gut) plays a role in the inflammatory pathophysiology of depression. Neuro Endocrinol Lett. 2008 Feb; 29(1):117-24.
10. Maes M, Coucke F, Leunis JC., Normalization of the increased translocation of endotoxin from gram negative enterobacteria (leaky gut) is accompanied by a remission of chronic fatigue syndrome., Neuro Endocrinol Lett. 2007 Dec; 28(6):739-44.
11. Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermúdez-Humarán LG, Gratadoux JJ, Blugeon S, Bridonneau C, Furet JP, Corthier G, Grangette C, Vasquez N, Pochart P, Trugnan G, Thomas G, Blottière HM, Doré J, Marteau P, Seksik P, Langella P., Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients., Proc Natl Acad Sci U S A. 2008 Oct 28; 105(43):16731-6.
12. David Daguet, Iris Pinheiro, An Verhelst, Sam Possemiers, Massimo Marzorati, Acacia gum improves the gut barrier functionality in vitro. Agro FOOD Industry Hi Tech - vol 26(4) - July/August 2015: 29-33.
13. Daguet D., Pinheiro I., Verhelst A., Possemiers S., and Marzorati M., Arabinogalactan and fructooligosaccharides improve the gut barrier function in distinct areas of the colon in the Simulator of the Human Intestinal Microbial Ecosystem. J.Fuct. Foods, 2016;20:369-79.
14. Patent pending N°WO 2015/162447
15. Lee SH., Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases, Intest Res. 2015 Jan;13(1):11-8.
16. Ulluwishewa D, Anderson RC, McNabb WC, Moughan PJ, Wells JM, Roy NC., Regulation of tight junction permeability by intestinal bacteria and dietary components., J Nutr. 2011 May;141(5):769-76.